Hvordan beregne vekten av Helium
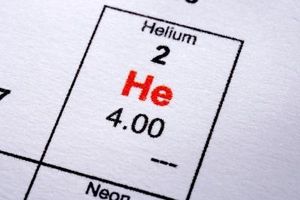
Helium er den første av de edle gasser, elementer som finnes i en monatomic tilstand på grunn av deres iboende stabilitet fører til en fundamental mangel på behov for å reagere med andre elementer for å eksistere i naturen. Fordi det eksisterer som en gass ved normale temperaturer og trykk kan det være vanskelig å beregne vekten av helium uten referanse til Avogadros konstant og prinsippet mol.
Bruksanvisning
1 Ta kontakt med en periodisk tabell for å sjekke atomvekten av helium. For å bestemme vekten av en gass, er det nødvendig å kjenne atomvekten til hvert element som utgjør molekylene i gassen. Som helium er monatomic, er det bare en heliumatom i hvert molekyl, og dens molekylvekt er derfor nøyaktig lik dens atomvekt; som er i gjennomsnitt 4. Merk molekylvekten på papiret.
2 Kontakt din termometer og trykkmåler for å bestemme temperaturen og trykket av heliumgass. Hvis temperaturen og trykket er nær eller lik standard temperatur og trykk, 273 Kelvin og en atmosfære henholdsvis, så kan du bestemme antall mol av helium du har ved å dividere med 22,4. Dette skyldes at 1 mol av en "ideell gass" under standard temperatur og trykk har et volum på 22,4 liter.
3 Multipliser antall mol helium du har av Avogadro nummer, 6,022 x 10 ^ 23, ved hjelp av kalkulatoren. Dette er antallet av heliumatomer man har; som ett mol av et stoff som inneholder 6,022 x 10 ^ 23 molekyler. Noter nummeret du beregne. Multiplisere antall av molekylvekten, 4, for å finne vekten av helium, i gram.
Hint
- Hvis du ønsker å beregne vekten av helium du har i pounds, kan du enten dele vekten du beregnes ved 453,59 eller multiplisere det med 0,0022. Dette vil konvertere gram målingen i pounds uten behov for å beregne en vekt ved hjelp av forskjellige verdier i hver ligning.
- For å beregne antallet mol nøyaktig, er det viktig at termometer og trykkmåler være kalibrert riktig før bruk. Se i bruksanvisningen for hver enhet for nøyaktige instruksjoner om hvordan du gjør dette. Selv en litt feil lesing kan produsere vilt unøyaktige målinger så nøye måling er viktig.
