Hvordan gjøre for pH Meters arbeid?
Et pH-meter anvendes til måling av pH (surhetsgrad) av en vandig oppløsning. En pH-måler består av en sonde og et voltmeter. De mest vanlige kommersielt tilgjengelige pH-prober består av et ikke-ledende glass eller plast ytre rør, en kombinasjon av referanse og indre elektroder, interne løsninger og en glasspære spiss. En kombinasjon referanse-indre elektrode er koblet til måleren via en kabel med to ledninger som er koplet til hver elektrode. Voltmeteret er en høy motstand enhet som måler nøyaktig potensialforskjellen mellom referanseelektroden og måle indre elektrode.
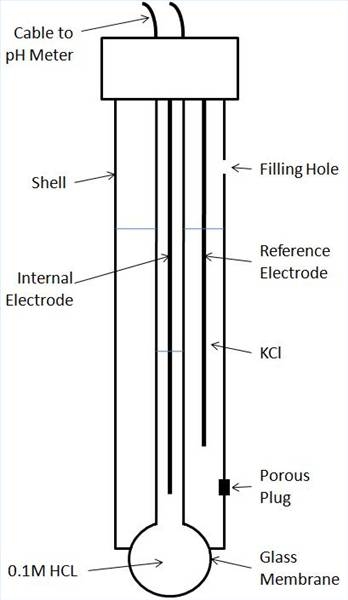
Både referanse og indre tverrelektroder er sølvklorid-belagte tråder, hver inneholdes i en egen avdeling, danner to halve celler i proben. Referanse og interne elektroder nedsenket i interne løsninger (med know pH) mettet KCl og 0,1 M HCl, henholdsvis. Ved enden av proben er en ioneselektiv membran glasspæren hvor føle inntreffer. Den glassmembran er typisk en blanding av Na2O, SiO2 og CaO.
For at føleren skal fungere riktig og gjennomgå den ønskede ion exchange prosess, må glassmembran spissen av en pH-probe hydratiseres i enten et lagrings- eller bufferoppløsning før - eller mellom - bruk. For å måle pH-verdien av en oppløsning, blir proben deretter fjernet fra lagringsløsningen, skyllet med avionisert vann, og deretter innføres i den vandige prøveoppløsning som skal måles. Sonden skal være nedsenket i testløsningen lenge nok til at pH målinger for å stabilisere.
Ved den ytre overflate av glassmembranen, hydrogenioner som er tilstede i testoppløsningen utveksling med natriumioner til stede i det hydratiserte lag av glassmembran. Når hydrogenioner blir ekstrahert inn i membranen, og potensialet over membranen endres mens potensialet til referanseelektroden forblir konstant. (De hydrogenioner ikke reiser gjennom den semipermeable membran glass.) Det er da en forskjell i hydrogen ionekonsentrasjoner i hvert hydratisert lag på begge sider av glassmembran. Måleren måler summen av alle potensialene i systemet, blant annet potensial over glasset, den indre elektrode og referanseelektroden. Ligningen som anvendes for å forbinde det skiftende membranpotensialet til konsentrasjonen av hydrogenioner, eller pH-verdien av prøveoppløsningen, er avledet fra Nernst-ligningen.
For pH-meter til riktig konvertere de målte potensialer til passende pH-verdier, må kalibreringer utføres på en jevnlig basis. Dette er typisk utført med to bufferoppløsninger med pH 4,01, 7,00 eller 10,00, avhengig av det forventede området for de prøveoppløsninger som skal måles. Feilaktige avlesninger i pH-måling kan oppstå ved mangel på temperaturkompensasjon, skade på membranen eller sonde, innesluttede luftbobler rundt referanseelektroden, våt sonde forbindelser til måleren, statisk elektrisitet, tilstedeværelsen av salter, organiske løsningsmidler, proteiner i testoppløsningen eller alkalisk feil ved pH større enn 12.
