Visualiseringsmetoder i det periodiske system
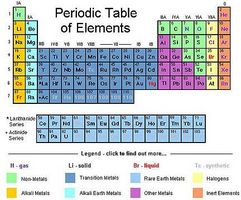
Kjemikere oppdaget i 1860-årene at dersom elementene er anordnet i den rekkefølgen av massen av deres atomer, kjemiske egenskaper gjentas regelmessig. Dmitrij Mendelejev publiserte sin versjon av den periodiske tabellen i 1869, og det fortsetter å være standard visuell presentasjon. Den periodiske tabell kan visualiseres noen forskjellige måter å hjelpe forståelse og sammenligning.
Grid Pattern av Mendelejev Table
Medeleyev bord bestilles i økende elektron telle fra venstre til høyre og nedover, som rekkefølgen av tekst på en side. Kolonnene svarer til hvor mange elektroner trenger å bli tapt eller vunnet for det ytre skall for å være fullstendig. Derfor er helium i den samme kolonne som neon, selv om man har to elektroner i sitt ytre skall og den andre har åtte.
Ved å tillate variasjon av antall elementer per rad, gjør det mulig for bordet elementer med forskjellig antall elektroner i det ytre skallet til å grupperes sammen ved deres affinitet for å plukke opp eller miste elektroner. På vei ned for rad, det antall elektroner som kreves for å fylle det ytre skallet øker. For eksempel, hydrogen og helium ta to elektroner i deres ytre (eneste) skall. I de neste to rader nedover, elementene ta opp til 8 elektroner i sitt ytterste skall. For eksempel, har argon en første indre skall av 2 elektroner, en andre indre skallet på 8, og et ytre skall av åtte.
Elementer i de neste to rader ned har ytre skall som holder opp til 18. De to neste radene tilsvarer ytre skall av opp til 32.
Fordi en hel ytre skall er en stabil konfigurasjon, kjemikalier feste på en slik måte for å fylle hverandres ytre skall ved å dele de ytre elektroner. Visualisere elementene på et rutenett derfor hjelper kjemikere å raskt identifisere elementer som vil reagere med hverandre, basert på hvor mange kolonner bort fra edelgass kolonne (oransje) de er.
For eksempel, de halogener (gult) er meget reaktiv med alkalimetaller (i gull). Alkaliske jordmetaller (i lyseblå) er svært reaktive med elementer i kolonne VIA. Og de edle gasser (i organe) er resistente mot reaksjon, fordi deres ytre skall er fulle, og dermed ikke kan bringes nærmere likevekt ved å låne eller låne et elektron fra et annet atom.
Regioner av Mendelejev Table
Regioner av rutenettet tabellen kan også være farget for å fremheve elementer med felles egenskaper. Halogenene er fremhevet fordi utover det å være meget reaktive med alkalimetaller, de er reaktive med metaller generelt, fordi de er så nær ved å ha komplette ytre skall.
Metalloider (ikke uthevet i diagram) består av B, Si, Ge, As, Sb, Te og Po. De er ofte fremhevet fordi de deler metalliske og ikke-metalliske kvaliteter med hverandre. Overgangsmetallene skiller seg fra andre metaller fordi deres elektronkonfigurasjon tillater dem å lett å gi opp det som kalles D elektroner. Den klare strøm av elektroner i overgangsmetaller som gjør dem til gode elektriske ledere.
spiral Representasjon
Forskere før og etter Mendelejev foreslo elementene bli arrangert i en spiral (se Ressurser).
En fordel med en slik representasjon er at det grupper (radialt) elementer med den samme affinitet for å gi opp eller miste et elektron, men uten diskontinuiteter. Elementer på hver eike har lignende kjemiske egenskaper. Mendelejev bord stopper på slutten av hver rad, med edelgasser. En spiral trenger ikke gjøre det. Mendelejev bord plasserer de sjeldne jordmetaller utenfor grid bruker fotnote notasjon. En spiral kan unngå at misforståelser også.
Visuell hukommelse Cues
En annen måte å representere bordet av elementer er med visuelle signaler, som vil hjelpe huske egenskaper og atomnummer (se Ressurser).
