Hvordan til fig Valence av elektroner i det periodiske system

Elektroner i bane rundt kjernen av et atom til faste energinivåer er kjent som hovedenerginivå, eller elektronskallene. Hver elektron skallet er sammensatt av ett eller flere subshells. Per definisjon valenselektroner reise i shell lengst bort fra atomkjernen. Atomer har en tendens til å akseptere eller mister elektroner om dette vil føre til fullstendig ytre skall. Følgelig valenselektroner direkte påvirke hvordan elementer oppfører seg i en kjemisk reaksjon.
Bruksanvisning
Figur Valence Elektroner for alle elementer unntatt Transition Metals
Finn ønsket element i det periodiske system. Hver rute i det periodiske system inneholder bokstaven symbol for et element trykkes direkte under atomnummeret for elementet.
For eksempel, lokalisere elementet oksygen på bordet. Oksygen er representert ved symbolet "O", og har et atomnummer på åtte.
2 Bestemme gruppenummeret og periode antall av elementet. De vertikale kolonnene i det periodiske system, regnet fra venstre mot høyre, 1 til 18, kalles grupper. I det periodiske system, elementene med lignende kjemiske egenskaper er i samme gruppe. De horisontale rader av det periodiske system, fra 1 til 7, kalles perioder. Perioder tilsvarer antallet av elektronskall besatt av atomer av elementene i denne raden.
Oksygen er funnet i periode 2, Gruppe 16.
3 Bruke regelen i det periodiske system til ditt element. Regelen er som følger: Hvis et element er ikke et overgangsmetall, så valens elektroner øke i antall som man telle grupper venstre til høyre langs en periode. Hver ny periode begynner med ett valenselektron.
Ekskluder grupper 3 til 12. Dette er overgangsmetaller, som har spesielle omstendigheter.
Etter denne regelen: Elementer i gruppe 1 har en valenselektron; elementer i gruppe 2 har to valenselektroner; elementer i gruppe 13 har tre valenselektroner; elementer i gruppe 14 har fire valenselektroner; og så videre opp til gruppen 18. elementer i gruppe 18 har åtte valenselektroner, med unntak av helium, som har bare to.
Oksygen er plassert i gruppe 16 i det periodiske systemet, slik at det har seks valenselektroner.
Figur Valence Elektroner for Transition Metals
Vær klar over unik elektronkonfigurasjon av overgangsmetaller.
Valence elektroner er generelt det som er igjen etter at alle de indre subshells av et atom er fylt. Imidlertid kan overgangsmetaller ha subshells som ikke er helt fylt. Et atom kan ha en tendens til å akseptere eller mister elektroner fra en ufullstendig subshell om dette vil resultere i en full subshell, så subshell elektroner kan oppføre seg som valenselektroner. Ved streng definisjon, de fleste overgangsmetaller har to valenselektroner, men kan ha et større utvalg av åpenvalenselektroner.
5 Finn overgangsmetall i det periodiske system og gjøre oppmerksom på gruppenummeret. Bruk jern som et eksempel, et overgangsmetall med symbolet Fe, atomnummer 26, som ligger på periode 4, gruppe 8. 6 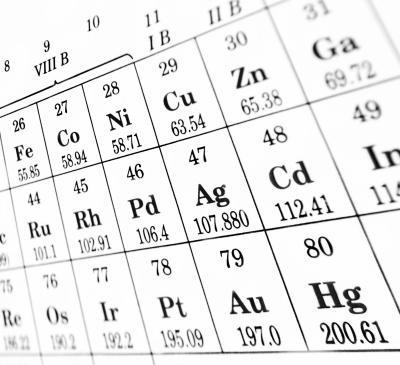
Bestemme omfanget av tilsynelatende valens electrons.by konsultere følgende tabell:
Gruppe 3: 3 valenselektroner
Gruppe 4: 2-4 valenselektroner
Gruppe 5: 2-5 valenselektroner
Gruppe 6: 2-6 valenselektroner
Gruppe 7: 2-7 valenselektroner
Gruppe 8: 2-3 valenselektroner
Gruppe 9: 2-3 valenselektroner
Gruppe 10: 2-3 valenselektroner
Gruppe 11: 1-2 valenselektroner
Gruppe 12: 2 valenselektroner
Elementet jern er i gruppe 8, og har derfor to eller tre tilsynelatende valenselektroner.
Hint
- Elektronskallene er merket K, L, M, N, O, P og Q eller bare 1 til 7; starter med skallet nærmest kjernen, og bevege seg ut. Hvert elektron skall kan holde en fast, maksimalt antall elektroner: K skallet har maksimalt to elektroner, holder L skall åtte elektroner, M shell holder atten elektroner og N skallet har en maksimalt trettito elektroner. Teoretisk sett kan det O Shell inneholder femti elektroner og P-skallet kan inneholde sytti-to elektroner, men ingen naturlig forekommende element har mer enn tretti-to elektroner i en enkelt skall.
- Maksimalt antall valenselektroner for et atom er åtte.
- Det er to linjer med elementer som er oppført nedenfor hovedtabellen på det periodiske diagrammet, lantanidene og aktinider. Alle lanthanides hører hjemme i periode 6, Gruppe 3. aktinider hører hjemme i periode 7, er konsernets 3. Disse elementene kalles indre overgangsmetaller.


