Hybrid orbitaler Definisjon
Atomer har en sentral kjerne av protoner og nøytroner. Elektronene med stor hastighet rundt kjernen i baner som kalles "orbitaler." I kovalente molekyler, forskjellige atomorbitalene og til kombineres for å danne et tilsvarende antall forskjellige, eller hybrid, orbitaler.
Non-Hybrid atomorbitalene
Ubundne atomer av alle elementer har lignende orbitaler på grunnlag av antall elektroner. For eksempel:
Hydrogen --- 1s¹
Helium ------ 1s²
Carbon ------ 1s² 2s² 2p²
Bly --------- 1s² 2s² 2p? 3s² 3p? 3d¹? 4s² 4p? 5s² 4d¹? 5p? 4f¹? 5d¹? 6s² 6p²
orbital geometri
Geometrier av s, p, d og f orbitaler er forskjellige. S orbitaler er sfærisk, p, d og f orbitaler peker i bestemte retninger i verdensrommet.
Molecule Formation
Molekyler dannes når atomer deler elektroner eller ett atom donerer et elektron til en annen. For å illustrere, to hydrogenatomer som deler sine s elektroner for å danne en to-elektron molekylær binding.
metan
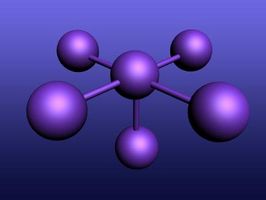
Metan, er CH ?, ett karbonatom bundet til fire hydrogenatomer. Dette krever fire elektroner fra hydrogen og fire elektroner fra karbon. Åtte elektroner danner fire obligasjoner. Bilde hydrogen donerer fire elektroner til karbon, som blir:
1s² 2s² 2p ?.
hybridisering
P elektron orbitaler peker i forskjellige retninger, så det er best å merke dem 2px², 2py², og 2pz². Uten hybridisering, ville metan dannes to typer molekylære bindinger. Alle metan obligasjoner er identiske. Den ene s og tre p orbitaler hybridiserer til å danne fire sp³ orbitaler. Hydrogenatomer er pekt til hjørnene av en karbon-sentrert tetraeder. Hybridisering står for ensartethet og geometri.
