Hvordan finne antall nøytroner i en Isotope
Isotoper er atomer av et grunnstoff med varierende antall nøytroner i sine kjerner. Alle atomer av et angitt element har samme antall protoner. Mens elektroner er tilstede i mange atomer, fordi de har så liten masse, er bare protoner og nøytroner i betraktning ved måling av massen til et atom. På grunn av at antall protoner ikke varierer fra atom til atom av et element, som er nummer betegnet med atomnummer. Nøytroner kan variere fra atom til atom, og blir beregnet ved å sammenligne massen av en isotop til standarden massen til et atom som bare inneholder den karakteristiske antall protoner.
Bruksanvisning
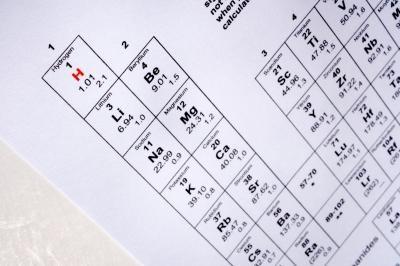
1 Finn element for isotopen aktuelle i det periodiske system. Legg merke til atomnummeret for det element. Atomnummeret er vanligvis skrevet i relativt stor skrift over elementets kjemisk symbol. Dette nummeret forteller deg det antall protoner i et atom av elementet.
2 Bestemme massen antall av isotopen ved å undersøke navn av isotopen. En spesiell isotop av et element er vanligvis merket med navnet på elementet og massen tallet for denne isotop. Tallet er enten i hevet over elementet symbol eller skrevet slik: karbon-12. Tilstedeværelsen av et massetall med et element som betegner det som en isotop av dette elementet.
3 Trekk atomnummer av elementet fra massen antall av isotopen å skaffe antallet nøytroner i den isotop. For eksempel, den atomnummer for Silisium (Si) er 14. En spesiell isotop av silisium er silisium-30. For å finne antall nøytroner i denne Si isotop, trekker atomnummer fra massen Nummer: 30-14 = 16. Derfor har Silicon-30 16 nøytroner og 14 protoner.
